新聞動態
2018年10月,全球第一款RNA藥物onpattro?獲批上市,這是諾貝爾獎成果從概念走向實際治療用途的一個里程碑。多年來的技術發展和積累,核酸藥物作為新一代治療方法初露崢嶸,隨著mRNA疫苗的獲批,RNA藥物進入蓬勃發展期。
為了確保這些RNA分子能夠有效地進入細胞并發揮作用,脂質納米粒功不可沒。它可以保護RNA分子不被體內酶分解,將其輸送到體內特定部位。脂質納米粒的成分通常包括膽固醇、輔助磷脂(DSPC,DOPE等)、聚乙二醇化脂質(DMG-mPEG20000,DSPE-mPEG2000以及陽離子脂質(DOTAP,DOTMA,D-Lin-MC3-DMA等)。
脂質體,作為脂質納米粒的前身。它們是由磷脂雙分子層自發形成的封閉小囊泡,與細胞膜結構相似,可以模擬細胞膜的性質。脂質體于20世紀60年代被Bangham等人發現,最初是用作研究細胞膜結構和功能的簡便模型,隨著技術的進步和更深入的研究,脂質體逐漸發展為一種潛在的藥物遞送載體。由于其兩親性的結構,脂質體可以攜帶多種不同的藥物。親水性藥物可以封閉在脂質體的水性內部區域,而疏水性藥物可以包裹在脂雙層的烴鏈區域中,如下圖。
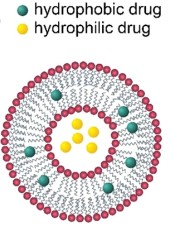
用于藥物遞送的脂質體主要由各類磷脂和膽固醇構成,其中磷脂(甘油磷脂和鞘磷脂)是其基本骨架。甘油磷脂是以甘油為骨架的脂質,鞘磷脂是以鞘氨醇為骨架的脂質,下圖是甘油磷脂和鞘磷脂的基本結構。
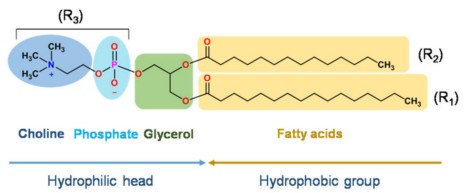
甘油磷脂結構示意圖
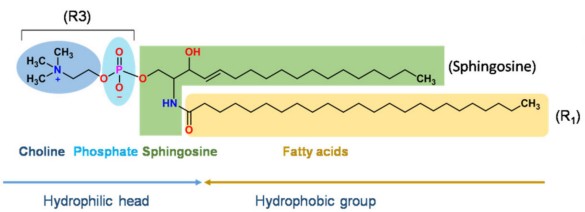
鞘磷脂結構示意圖
注:R1和R2可以是飽和脂肪酸或不飽和脂肪酸,如月桂酸、棕櫚酸、油酸、芥酸等。R3在不同的pH值下可以是中性的磷脂酰膽堿(PC)、磷脂酰乙醇胺(PE),也可以是負荷電的磷脂酰絲氨酸(PS)、磷脂酰肌醇(PI)、磷脂酸(PA)、磷脂酰甘油(PG)。
膽固醇是一種兩親性中性脂質,可以調節脂質雙分子層的流動性,通過增加脂質體的穩定性,減少藥物的泄露,起到延長和控制藥物釋放的作用。
除了磷脂和膽固醇,脂質體還可以添加多糖(如寡聚糖、殼聚糖、透明質酸)和表面活性劑等膜材料,以提高脂質體的穩定性并調控藥物的釋放。
根據不同的結構和性能,脂質體可以分為單層脂質體、多層脂質體和多囊脂質體等類型。此外,根據脂質體所帶電荷,可以分為陽離子脂質體(如DOTAP)、陰離子脂質體(如DOPS)和中性脂質體(如DSPE)。根據不同的功能,還有長循環脂質體、糖基修飾脂質體、熱敏脂質體、pH敏感脂質體、免疫脂質體、磁性脂質體和彈性脂質體等。
脂質體屬于熱不穩定體系,容易出現藥物泄露和降解等問題。為了實現靶向治療,穩定性是脂質體不可或缺的因素。脂質體的穩定性包括物理穩定性、化學穩定性和生物穩定性。物理穩定性和化學穩定性通常是指脂質體制劑在一定時間內保持其特性的能力。磷脂容易發生化學降解反應,如酯鍵水解和不飽和酰基鏈的過氧化反應,這些現象會影響脂質體制劑的長期穩定性。另外,為了保持脂質體囊泡結構的完整,需要平衡脂質體內部和脂質體之間的各種相互作用力。選擇飽和磷脂或低飽和度的磷脂、合適的雙層濃度、適當的緩沖液種類,以及添加抗氧化劑、金屬螯合劑和冷凍保護劑等都可以增加脂質體的穩定性。
生物穩定性指的是在血清蛋白存在的情況下,脂質體能夠保持其完整性。在血液中,脂質體與血清蛋白結合后,會發生調理作用,導致脂質體被快速清除。為了增強生物穩定性,可以添加聚乙二醇(PEG)等物質來避免調理作用,延長脂質體在血液中的循環時間。
脂質體在結構上與生物膜相似,具有很好的生物相容性,脂質體作為藥物載體,具有以下優勢:
1. 可以攜帶不同種類的藥物/基因:脂質體特殊的雙分子層結構,可以封閉和保護多種不同類型的藥物和基因,包括水溶性和脂溶性藥物。
2. 具有不同途徑給藥的潛力:脂質體可以通過不同的途徑進行給藥,包括口服、注射、局部應用等,可以根據具體需要選擇最適合的給藥途徑。
3. 防止化學和生物降解:脂質體與細胞膜結構相似,可以保護藥物免受化學和生物降解的影響,延長藥物的半衰期,提高藥物的穩定性和生物利用度。
4. 降低藥物的非特異性副作用和毒性:脂質體可以將藥物封閉在內部,減少藥物對非靶向組織的影響,降低非特異性副作用和毒性,提高藥物的療效和治療指標。
5. 多功能性的化學修飾和靶向能力:脂質體可以進行化學修飾,通過附著特定的配體或功能基團實現靶向效果,提高藥物的靶向性和選擇性。
6. 生物降解、無毒材料相容:脂質體可以與可生物降解且無毒的材料相容,減少對人體的不良影響。
由于脂質體具有良好的生物相容性、無毒性和多樣化的藥物攜帶能力,脂質體在藥物遞送系統中具有廣泛的應用前景。Doxil的研究成功,鼓舞了脂質體載藥體系的研究與開發,因而脂質體被廣泛應用于各大疾病治療領域。
脂質體在藥物遞送領域中最主要的應用是癌癥治療。癌癥是一種身體健康細胞失控分裂的疾病,被認為是本世紀的一大醫學挑戰。通常來講,腫瘤部位的血管通透性通常更高,脂質體可以通過毛細血管上皮細胞靶向進入腫瘤組織,此外,脂質體結構具有高度的靈活性,可以修飾各種聚合物和配體等,提高穩定性的同時實現更好的靶向效果。脂質體能夠攜帶具有不同物理化學特性的藥物,因此被認為是納米醫學中藥物遞送和癌癥治療的理想選擇。在癌癥治療領域,脂質體載藥體系顯示出了巨大的潛力。多年來,隨著研究的深入,脂質體作為抗腫瘤藥物載體的治療途徑和方法也越來越廣泛,目前已有一些用于癌癥治療的藥物如Marqibo?(長春新堿)、力樸素(紫杉醇)和Onivyde?(伊立替康)等。
另一個重要的應用領域是抗真菌治療。真菌感染對人類健康構成越來越大的威脅,尤其對于免疫缺陷人群,侵襲性真菌感染的發病率和死亡率尤為突出。生物膜作為真菌的天然屏障,會影響抗真菌藥物對菌體的作用,降低藥物的攝取,使得抗真菌藥物難以發揮效用。脂質體作為藥物載體具有良好的生物相容性,可以降低藥物的毒副作用。與生物膜相似的結構能夠與微生物細胞質膜融合,將高濃度的藥物釋放到細胞膜或細胞質中,實現更高效的輸送和避免藥物外排。目前用于抗真菌治療的藥物有兩性霉素B類脂質體,如Ambisome?、Abelcet?和Amphotec?等。
除了癌癥治療和抗真菌治療,脂質體在其他領域也有廣泛的應用。例如在眼部疾病治療中,使用脂質體載藥體系治療眼部感染。此外,脂質體還可用于抗瘧疾治療、制備脂質體疫苗(如流感疫苗)、克服生物屏障(如血腦屏障,治療阿爾茨海默病)等方面取得了不錯的成果。
然而,脂質體的大規模生產一直面臨挑戰,且成本較高,這導致脂質體在市場上的定位偏高。盡管如此,隨著科學技術的進步,人們對脂質體和納米醫學作為藥物遞送系統持續發展的期望依然很高。
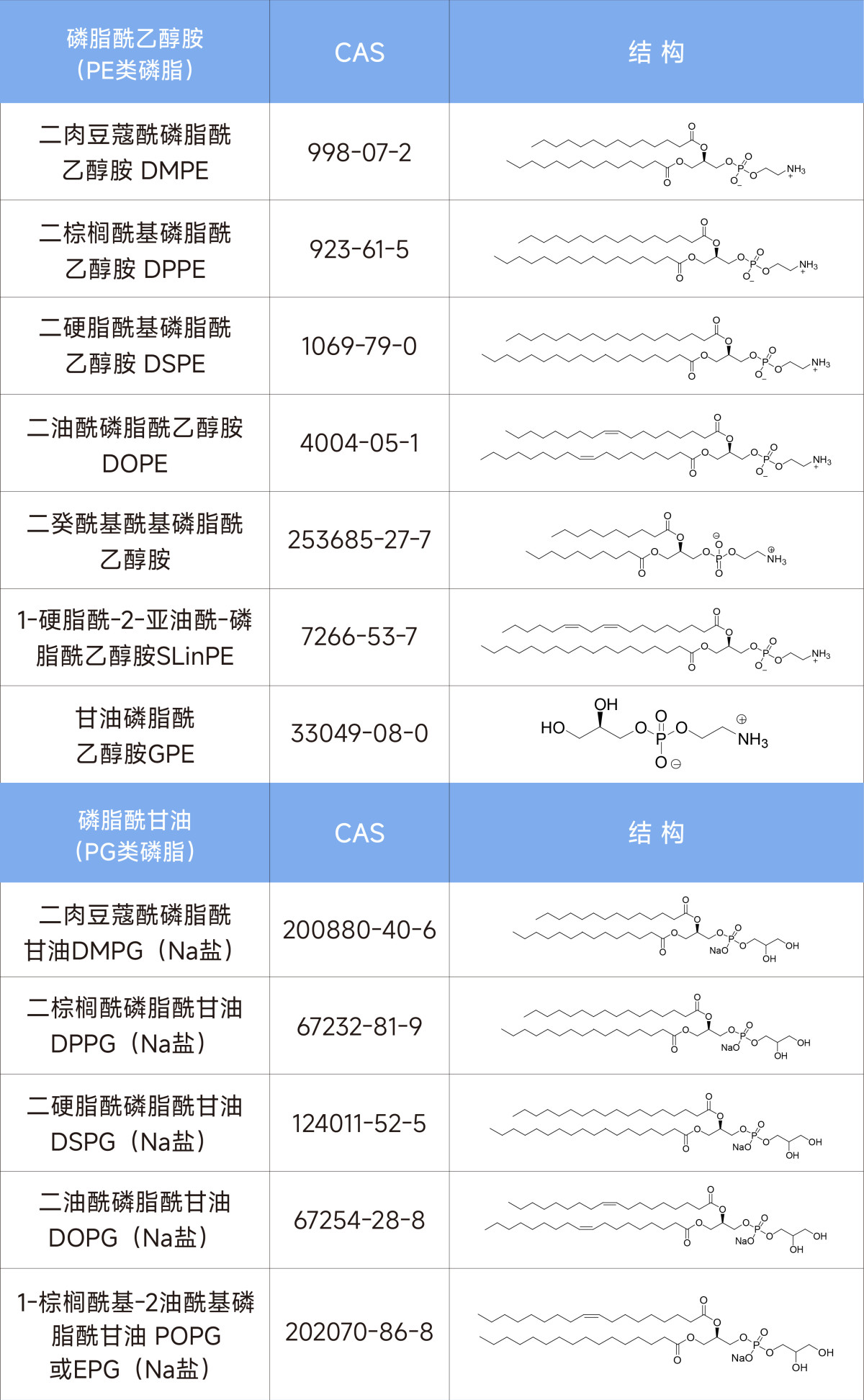
蘇州昊帆生物股份有限公司成立于2003年,專注于縮合劑、多肽藥物、抗體偶聯藥物的雙官能試劑以及脂質體膜材等領域。在脂質體領域,本公司可以為脂質體科研工作者提供種類豐富的各類磷脂試劑和相關膜材,歡迎來電垂詢(具體產品見表1)。
表1 昊帆的脂質體膜材產品



參考文獻:
[1]Pattni,B.S.;Chupin,V.V.;TorchilinV.P.NewDevelopmentsinLiposomalDrugDelivery[J].Chem.Rev.2015,115,10938-10966.
[2]楊福愉.脂質體(Liposome)在生物膜研究和藥物學方面的應用[J].生物化學與生物物理進展.1977,06,36-40.
[3]Tenchov,R.;Bird,R.;Zhou,Q.Q.;etal.LipidNanoparticles─FromLiposomestomRNAVaccineDelivery,aLandscapeofResearchDiversityandAdvancement[J].ACSNano.2021,15,16982-17015.
[4]Liu,P.;Chen,G.L.;Zhang,J.C.AReviewofLiposomesasaDrugDeliverySystem:CurrentStatusofApprovedProducts,RegulatoryEnvironments,andFuturePerspectives[J].Molecules.2022,27,1372-1394.
[5]劉揚,呂萬良,張強.脂質體及納米粒藥物遞送系統的研究進展[J].中國醫學科學院學報.2006,28,583-589.
[6]Hussain,A.;Singh,S.;Sharma,D.;etal.Elasticliposomesasnovelcarriers:recentadvancesindrugdelivery[J].IntJNanomedicine.2017,12,5087-5108.
[7]Torchilin,V.P.Recentadvanceswithliposomesaspharmaceuticalcarriers[J].NatRevDrugDiscov.2005,4,145–160.
[8]Filipczak,N.;Pan,J.Y.;Yalamarty,S.S.K.;etal.Recentadvancementsinliposometechnology[J].AdvancedDrugDeliveryReviews.2020,156,4-22.
[9]Large,D.E.;Abdelmessih,R.G.;Fink,E.A.;etal.Liposomecompositionindrugdeliverydesign,synthesis,characterization,andclinicalapplication[J].AdvancedDrugDeliveryReviews.2021,176,113851
[10]黃梓源,孫玉琦,胡海洋,莊蕊,徐琪,陳大為.脂質體制劑學穩定性的研究技術與方法[J].藥學學報,2016,51,356-361.
[11]Samad,A.;Sultana,Y.;Aqil,M.LiposomalDrugDeliverySystems:AnUpdateReview[J].CurrentDrugDelivery.2007,4,297-305.
[12]Ebrahim,S.;Peyman,G.A.;Lee,P.J.ApplicationsofLiposomesinOphthalmology[J].SurvOphthalmol.2005,50,167-182.
[13]Nsairat,H.;Khater,D.;Sayed,U.;etal.Liposomes:structure,composition,types,andclinicalapplications[J].Heliyon.2022,8,9394.
[14]Rommasi,F.;Esfandiari,N.LiposomalNanomedicine:ApplicationsforDrugDeliveryinCancerTherapy[J].NanoscaleResLett.2021,16,95.
[15]陳水生,周可倩,李曉東,呂權真,俞媛.納米藥物遞釋系統在抗真菌感染治療中的應用及機制.藥學學報,2021,56,1893-1901.

